Romosozumab è un anticorpo monoclonale che, inibendo l’attività della sclerostina, provoca un aumento della formazione ossea e contemporaneamente, in misura minore, riduce la perdita di massa ossea.
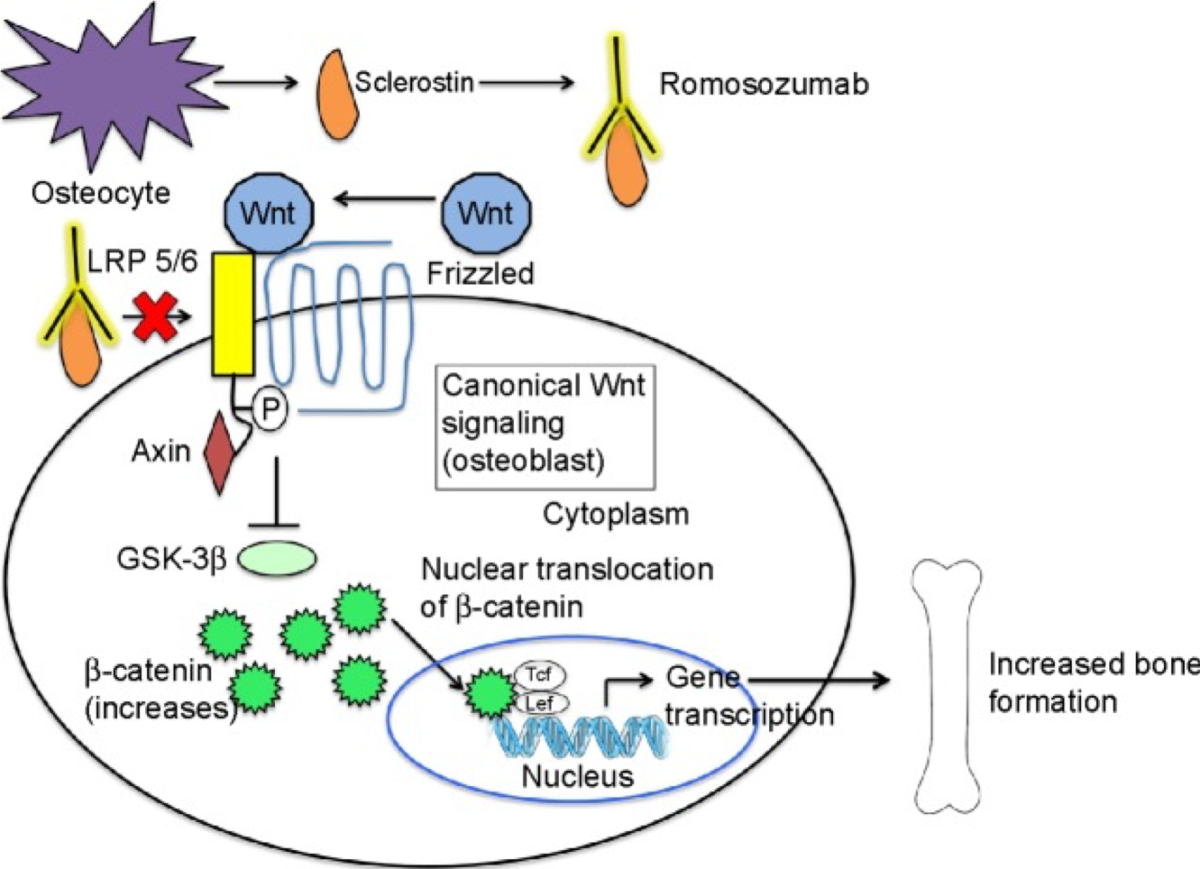
L’anticorpo monoclonale (MAb) umanizzato romosozumab lega la sclerostina (un inibitore della segnalazione della via Wnt secreto dall’osteocita) in circolazione. Ciò impedisce il legame della sclerostina con i recettori LRP 5/6. Pertanto, Wnt si lega a LRP 5/6 e al suo co-recettore Frizzled. Ciò porta all’attivazione della via di segnalazione Wnt, che alla fine porta alla differenziazione, alla proliferazione e alla sopravvivenza degli osteoblasti e, quindi, all’aumento della formazione ossea.
Shah AD, Shoback D, Lewiecki EM. Sclerostin inhibition: a novel therapeutic approach in the treatment of osteoporosis. Int J Womens Health. 2015;7:565–580.
Indicazioni
Romosozumab è indicato per il trattamento dell’osteoporosi severa nelle donne in postmenopausa ad alto rischio di frattura, definito attraverso una storia di fratture osteoportiche o più fattori di rischio per fratture, o in pazienti inotollerati o in cui sono fallite altre terapie disponibili per il trattamento dell’osteoporosi.
ll programma di sviluppo di romosozumab ha compreso 19 studi clinici che hanno arruolato circa 14.000 pazienti.
Romosozumab è stato studiato per le sue potenzialità di ridurre il rischio di fratture in un vasto programma globale di Fase 3 che includeva due grandi studi sulle fratture confrontando romosozumab con placebo o comparatore attivo in oltre 11.000 donne in postmenopausa con osteoporosi. Amgen e UCB stanno co-sviluppando romosozumab.
Nel dicembre 2019, il medicinale ha ricevuto dalla Commissione europea l’autorizzazione all’immissione in commercio.
Informazioni importanti sulla sicurezza di romosozumab nell’UE/EEA
Nell’UE, romosozumab è indicato per il trattamento dell’osteoporosi grave nelle donne in postmenopausa ad alto rischio di fratture.
Controindicazioni
Romosozumab è controindicato in pazienti allergici al romosozumab o a uno qualsiasi degli eccipienti, con bassi livelli di calcio nel sangue (ipocalcemia) o con anamnesi di infarto del miocardio (infarto) o ictus.
Infarto miocardico o ictus
Infarto e ictus sono stati riportati in pazienti in trattamento con romosozumab in studi randomizzati e controllati (non comune). Il trattamento con romosozumab non deve essere iniziato in pazienti con anamnesi di infarto o ictus. Nel determinare se usare romosozumab per un singolo paziente, deve essere valutata la presenza di fattori di rischio per problemi cardiovascolari, tra cui malattie cardiovascolari accertate, ipertensione, livelli elevati di grassi nel sangue, diabete, fumo o problemi renali. Romosozumab deve essere usato solo se il medico prescrittore e il paziente concordano sul fatto che il beneficio supera il rischio. Se un paziente manifesta un infarto miocardico o un ictus durante la terapia, il trattamento con romosozumab deve essere interrotto.
Ipocalcemia
In pazienti in trattamento con romosozumab è stata osservata ipocalcemia transitoria. L’ipocalcemia deve essere corretta prima di iniziare la terapia con romosozumab e i pazienti devono essere monitorati per segni e sintomi di ipocalcemia. Se un paziente presenta sospetti sintomi di ipocalcemia durante il trattamento, devono essere misurati i livelli di calcio. Nei pazienti devono essere adeguatamente integrati calcio e vitamina D. I pazienti con grave insufficienza renale (tasso di filtrazione glomerulare stimato [eGFR] da 15 a 29 ml/min/1,73 m2) o sottoposti a dialisi sono a maggior rischio di sviluppare ipocalcemia e dati di sicurezza per questi pazienti sono limitati. In questi pazienti devono essere monitorati i livelli di calcio.
Ipersensibilità
Negli studi clinici, nel gruppo romosozumab, si sono verificate reazioni cliniche significative di ipersensibilità, inclusi angioedema, eritema multiforme e orticaria. Se si verifica una reazione anafilattica o altra reazione allergica clinicamente significativa, deve essere iniziata una terapia appropriata e l’uso di Romosozumab deve essere interrotto.
Osteonecrosi mascellare
L’osteonecrosi della mascella (ONJ) è stata segnalata raramente in pazienti in trattamento con romosozumab.
I seguenti fattori di rischio devono essere considerati nella valutazione del rischio di un paziente di sviluppare ONJ:
- potenza del medicinale che inibisce il riassorbimento osseo (il rischio aumenta con la potenza antiriassorbitiva del composto) e dose cumulativa di terapia di riassorbimento osseo;
- cancro, condizioni di comorbilità (ad es. anemia, coagulopatie, infezione), fumo;
- terapie concomitanti: corticosteroidi, chemioterapia, inibitori dell’angiogenesi, radioterapia alla testa e al collo;
- scarsa igiene orale, malattia parodontale, mal adattamento protesi dentarie, storia di malattia dentale, procedure dentali invasive (ad es. estrazioni dentarie).
Tutti i pazienti devono essere incoraggiati a mantenere una buona igiene orale e ricevere controlli dentali di routine. La dentiera dovrebbe adattarsi correttamente. Durante il trattamento con tomosozumab, i pazienti sottoposti a trattamento odontoiatrico o sottoposti a chirurgia dentale (ad es. estrazioni dentali) devono informare il proprio medico in merito al loro trattamento odontoiatrico e informare il dentista che stanno assumendo romosozumab. Durante il trattamento con romosozumab,i pazienti devono segnalare immediatamente qualsiasi sintomo orale come mobilità dentale, dolore o gonfiore o non guarigione di piaghe o secrezione di pus. I pazienti che sono sospettati di avere o che sviluppano ONJ mentre ricevono romosozumab devono ricevere cure da un dentista o un chirurgo orale con esperienza in ONJ. L’interruzione della terapia con romosozumab deve essere presa in considerazione fino a quando la condizione non si risolve e, ove possibile, si mitigano i fattori di rischio.
Fratture femorali atipiche
In pazienti in trattamento con romosozumab sono state riscontrate raramente fratture atipiche a bassa energia o a basso trauma dello stelo femorale, che possono verificarsi spontaneamente. Qualsiasi paziente con dolore nuovo o insolito alla coscia, all’anca o all’inguine deve essere sospettato di avere una frattura atipica e deve essere valutato per escludere una frattura incompleta del femore. I pazienti che presentano una frattura atipica del femore devono essere valutati anche per sintomi e segni di frattura dell’arto controlaterale. In base a una valutazione del rapporto rischio-beneficio individuale deve essere presa in considerazione l’interruzione della terapia con reomosozumab.
Reazioni avverse
Le reazioni avverse più comuni sono state rinofaringite (13,6%) e artralgia (12,4%). Le reazioni avverse comuni includevano: ipersensibilità, sinusite, eruzione cutanea, dermatite, mal di testa, dolore al collo, spasmi muscolari e reazioni nel sito di iniezione (le reazioni più frequenti nel sito di iniezione erano dolore ed eritema). Reazioni avverse non comuni sono state: orticaria, ipocalcemia, ictus, infarto del miocardio e cataratta. Infine, rari effetti collaterali sono state gravi reazioni allergiche che hanno causato gonfiore di viso, gola, mani, piedi, caviglie o parte inferiore delle gambe (angioedema) ed eruzione cutanea acuta (eritema multiforme).
Romosozumab è soggetto a monitoraggio addizionale.
Articoli correlati
Romosozumab, approvazione CE per trattamento di osteoporosi severa
