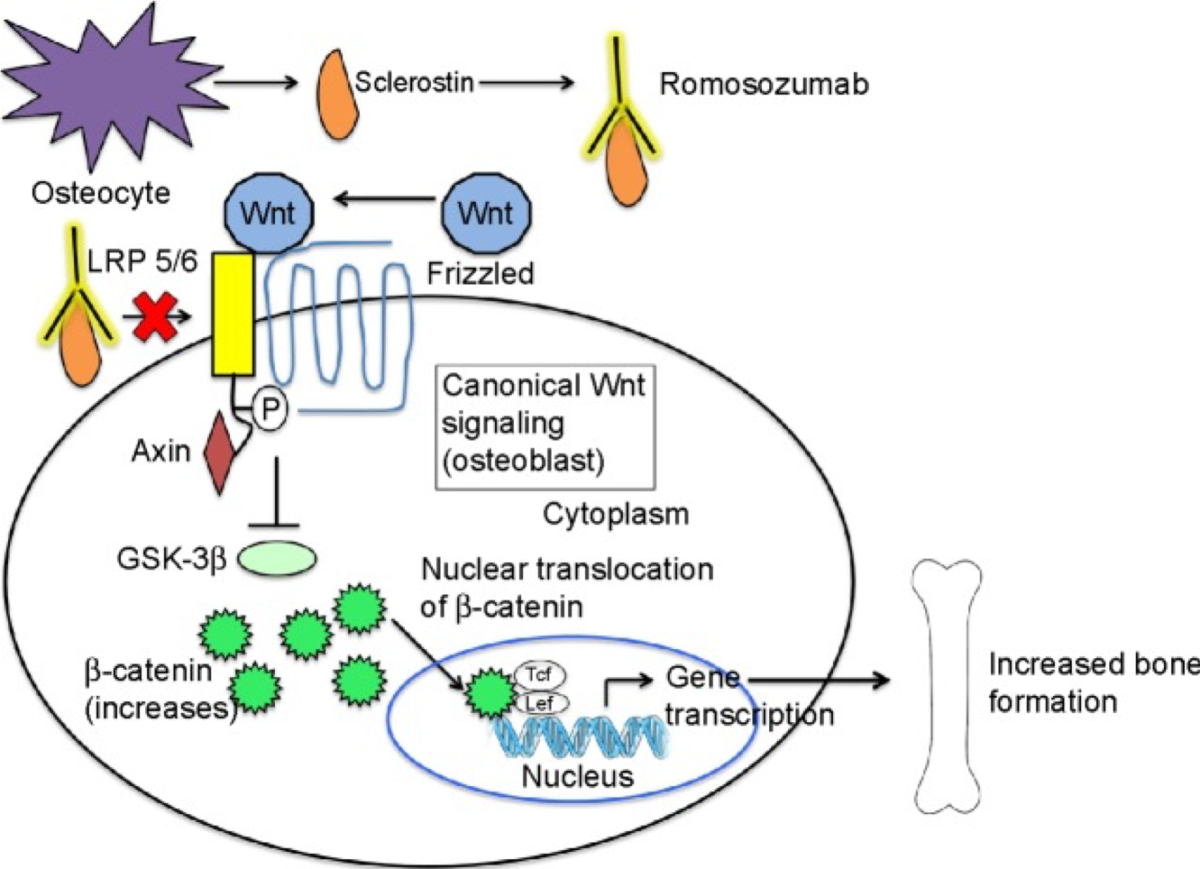
Nelle pazienti con anoressia nervosa (AN), l’osteoporosi rappresenta una complicanza comune e grave, che normalmente persiste anche dopo il recupero del peso e la ripresa del ciclo mestruale regolare. La condizione può causare dolore, lesioni e disabilità significativi.
Un gruppo di ricercatori del Colorado ha pubblicato il caso di un completo ritorno alla normale densità ossea dopo molti anni di grave osteoporosi in una paziente gravemente malnutrita con anoressia nervosa. Gli autori riferiscono di non conoscere altre pubblicazioni che riportano casi analoghi.
Osteoporosi e anoressia nervosa
La perdita ossea nei pazienti con AN è multifattoriale: è il risultato di uno squilibrio di ormoni sessuali e di altri fattori endocrini nonché degli effetti diretti della denutrizione. La perdita di densità minerale ossea (BMD) si verifica rapidamente, spesso entro sei mesi dall’esordio della malattia [1] e persiste anche dopo il recupero del peso [2]. Cause specifiche di bassa BMD nell’AN, nonostante la giovane età tipica dei pazienti con AN, comprendono ipoestrogenismo, ipoandrogenismo, malnutrizione, ridotta massa corporea magra e ipercortisolemia. Inoltre, nei pazienti con AN, nonostante i livelli elevati di ormone della crescita (GH), il fattore di crescita insulino-simile 1 (IGF-1) è ridotto, a causa di uno stato acquisito resistente al GH. Un ruolo può essere svolto anche dall’aumento dei livelli di grelina e peptide AA [3, 4].
Gli autori della pubblicazione dichiarano di non essere a conoscenza di segnalazioni di casi che descrivono il trattamento terapeutico per l’osteoporosi completamente efficace e che testimoniano l’inversione dell’osteoporosi grave in pazienti con AN grave; ritengono quindi di interesse riportare il caso di una paziente con anoressia nervosa grave diagnosticata in età pre-adolescenziale e con osteoporosi che, dopo vent’anni, ha raggiunto un ritorno alla normale densità ossea.
Questo caso clinico può facilitare ulteriori ricerche sull’utilità tempestiva dell’utilizzo di teriparatide e di altri farmaci nel trattamento di casi di AN grave con osteoporosi.
Un caso di ripristino della normale densità ossea
Il caso si riferisce a una donna di 27 anni con una storia di 17 anni di AN grave, a cui a era stata diagnosticata per la prima volta l’osteoporosi all’età di 14 anni. Il disturbo alimentare aveva avuto esordio all’età di 10 anni quando, a seguito di un episodio di intossicazione alimentare acuta, aveva iniziato per la prima volta a seguire una dieta restrittiva e ad avere comportamenti compulsivi. Da quel momento, è stata ricoverata in ospedale quasi 100 volte e ha ricevuto cure specialistiche per il trattamento di disordini alimentari in regime di ricovero ospedaliero e residenziale per periodi variabili da alcune settimane a diversi mesi. Il peso più basso raggiunto dalla paziente in età adulta è stato di 19,5 kg (162 cm di altezza, BMI 7,4) e il più alto di 50,8 kg (BMI 19,2).
L’osteoporosi era stata diagnosticata per la prima volta nell’anca e nella colonna vertebrale all’età di 14 anni. Da quel momento, la paziente è stata sottoposta a scansioni per valutare la densità ossea (DXA) ogni 1-2 anni, mostrando un peggioramento della densità ossea fino all’età di 25 anni, nonostante le terapie seguite: tra i 15 e i 17 anni ha assunto 1000 mg di supplementazione di carbonato di calcio; a 18 anni ha iniziato il trattamento settimanale con sodio alendronato che è stato sospeso dopo tre mesi perché causa di nausea; tra i 19 e i 22 anni, la paziente ha ricevuto un trattamento annuale con acido zolendronico IV con continuo declino della densità minerale ossea.
La paziente non ha mai avuto menarca spontaneo. Ha iniziato l’associazione di pillole anticoncezionali orali (drospirenone 3 mg ed etinilestradiolo 0,02 mg) tra i 19 e i 22 anni. Dall’età di 23 anni, la paziente ha utilizzato cerotti estradiolici transdermici bisettimanali (0,075 mg/die) e ha assunto 200 mg di progesterone micronizzato bioidentico per i primi 12 giorni di ogni mese. Ha mestruato regolarmente ogni mese dall’inizio del trattamento con estradiolo transdermico e progesterone.
All’età di 23 anni, la paziente ha iniziato un programma di strength conditioning bisettimanale con sessioni della durata di circa 45 minuti. Ha eliminato la caffeina dalla dieta e consumato ogni giorno un quantitativo di calcio adeguato attraverso una combinazione di dieta e integrazione. In quel momento, il livello di vitamina D-25OH della paziente era di a 19 nmol/l e mostrava una risposta minima all’integrazione fino a quando non le sono state somministrate dosi settimanali di 50.000 UI di vitamina D per sei settimane. La paziente ha quindi mantenuto i livelli di vitamina D tra 40 e 50 nmol/l assumendo 10.000 UI di vitamina D al giorno.
All’età di 23 anni, la paziente ha subito una frattura spontanea del quinto metatarso sinistro. Nonostante l’adesione alle raccomandazioni terapeutiche, sono state necessarie 12 settimane affinché la paziente potesse camminare di nuovo senza dolore. La paziente ha subito un’altra frattura un anno dopo nello stesso sito a causa delle camminate eccessive e del jogging.
Nel luglio 2015 e nel dicembre 2015, rispettivamente all’età di 24 anni e poco dopo il suo venticinquesimo compleanno, la paziente ha assunto denosumab. Il suo peso a quel tempo variava tra 24 e 35 kg (BMI 8,9–13,4). In quell’anno la sua scansione DXA ha fatto registrare i primi miglioramenti nella densità minerale ossea (punteggi T tra -2,3 e -1,2) da quando le era stata diagnosticata l’osteoporosi.
Nel maggio 2016, la paziente ha avuto una frattura spontanea della prima costola che è stata diagnosticata per coincidenza durante l’esecuzione di una radiografia per una spalla lussata. Un anno dopo, a giugno 2016, la paziente ha anche iniziato un ciclo di trattamento di iniezioni giornaliere di teriparatide che è continuato per due anni. I risultati della scansione DXA ottenuti a dicembre 2016 stati i seguenti:
| Sito |
BMD (g/cm2)
|
T-score (STD)
|
Z-score (STD)
|
| L1-L4 |
0,962
|
−1,8
|
− 1,0
|
| Collo del femore sinistro |
0,881
|
−1,1
|
−0,6
|
| Totale femore sinistro |
0,814
|
−1,5
|
−0,9
|
| Collo del femore destro |
0,909
|
−0,9
|
−0,4
|
| Totale femore destro |
0,814
|
−1,5
|
−0,9
|
Durante il trattamento quotidiano con teriparatide, il peso della paziente variava tra 26 e 38 kg (BMI 10,0-14,4) e non ha mostrato effetti collaterali durante o dopo questo ciclo di trattamento.
I risultati della scansione DXA più recenti della paziente, risalenti all’agosto 2018, hanno mostrato valori di densità ossea nell’intervallo normale per età e sesso:
| Sito |
BMD (g/cm2)
|
T-score (STD)
|
Z-score (STD)
|
| L1-L4 |
1,019
|
−1,3
|
− 0,3
|
| Collo del femore sinistro |
0,934
|
−0,8
|
−0,0
|
| Totale femore sinistro |
0,881
|
−1,0
|
−0,2
|
| Collo del femore destro |
0,934
|
−0,7
|
−0,0
|
| Totale femore destro |
0,867
|
−1,1
|
−0,3
|
In particolare, il femore sinistro ha mostrato un aumento di densità ossea di 0,067 g/cm2, con una variazione dell’8,2%. Il femore destro ha mostrato un aumento di densità di 0,053 g/cm2, con una variazione del 6,5%.
Una speranza per pazienti anoressiche con osteoporosi
Al momento, non esiste una raccomandazione terapeutica standard per pazienti con anoressia grave che hanno l’osteoporosi. Il ripristino del peso e la ripresa delle mestruazioni rimangono i pilastri del trattamento. Tuttavia, uno studio longitudinale sugli adolescenti AN ha mostrato un impatto negativo duraturo sulla salute delle ossa anche dieci anni dopo la normalizzazione del peso corporeo [5]. Studi precedenti hanno anche riportato un aumento persistente e a lungo termine del rischio di fratture ossee molti anni dopo la diagnosi iniziale di AN [6]. Inoltre, data la natura spesso cronica e refrattaria della malattia e l’aumento del rischio di fratture a lungo termine in questa popolazione giovane, il caso di cui sopra richiede ulteriori indagini sull’uso di denosumab e teriparatide in pazienti con AN che hanno osteoporosi.
Il caso di questa paziente sembra allinearsi con studi che suggeriscono che la teriparatide aumenta la BMD e diminuisce il rischio di frattura vertebrale e frattura dell’anca a causa dei suoi effetti anabolici sulla formazione di nuovo tessuto osseo [7]. Teriparatide ha anche dimostrato di aumentare la BMD della colonna vertebrale in pazienti con AN dopo soli 6 mesi di terapia [8].
Un caso clinico sull’uso di denosumab in una paziente osteoporotica con AN ha dimostrato un miglioramento della BMD anche con questo trattamento [9].
Questi risultati supportano anche i dati tratti dallo studio DATA a due anni [10] e gli esiti cumulativi a quattro anni dallo studio di estensione, DATA-Switch [11], che mostrano che la combinazione di teriparatide e denosumab ha sovraperformato entrambi i farmaci individualmente.
In sintesi, continuano a essere necessari e giustificati rigorosi studi controllati randomizzati per determinare l’efficacia di interventi – nuovi e tradizionali – per la gestione dell’osteoporosi nell’anoressia nervosa e in altre popolazioni, data l’elevata prevalenza di bassa BMD nella popolazione [12].
Questo caso clinico fornisce la speranza che un uso oculato dei farmaci e un attento e tempestivo monitoraggio della densità ossea possano portare a miglioramenti della salute delle ossa.
Il caso di studio
Anand, P., Mehler, P.S. Osteoporosis recovery in severe anorexia nervosa: a case report. J Eat Disord 7, 38 (2019)
Riferimenti bibliografici
[1] Biller BM, Saxe V, Herzog DB, Rosenthal DI, Holzman S, Klibanski A. Mechanisms of osteoporosis in adult and adolescent women with anorexia nervosa. J Clin Endocrinol Metab. 1989;68:548–54.
[2] Rigotti NA, Neer RM, Skates SJ, et al. The clinical course of osteoporosis in anorexia nervosa: a longitudinal study of cortical bone mass. JAMA. 1991;265(9):1133–8.
[3] Misra M, Klibanski A. Anorexia nervosa and osteoporosis. Rev Endocr Metab Disord. 2006;7(1–2):91–9.
[4] Teng K. Premenopausal osteoporosis, an overlooked consequence of anorexia nervosa. Cleve Clin J Med. 2011;78(1):50–8.
[5] Mumford J, Kohn M, Briody J, Miskovic-Wheatley J, Madden S, Clarke S, Biggin A, Schindeler A, Munns C. Long-term outcomes of adolescent anorexia nervosa on bone. J Adolesc Health. 2019;64(3):305–10. Epub 2018 Dec 11.
[6] Lucas AR, Melton LJ, Crowson CS, O’Fallon WM. Long-term fracture risk among women with anorexia nervosa: a population-based cohort study. Mayo Clin Proc. 1999;74(10):972–7.
[7] Bodenner D, Redman C, Riggs A. Teriparatide in the management of osteoporosis. Clin Interv Aging. 2007;2(4):499–507.
[8] Fazeli PK, Wang IS, Miller KK, Herzog DB, Misra M, Lee H, Finkelstein JS, Bouxsein ML, Klibanski A. Teriparatide increases bone formation and bone mineral density in adult women with anorexia nervosa. J Clin Endocrinol Metab. 2014;99(4):1322–9.
[9] Jamieson A, Pelosi A. Use of Denosumab in a patient with chronic anorexia nervosa and osteoporosis. Am J Med. 2016;129(2):e47.
[10] Leder BZ, Tsai JN, Uihlein AV, Burnett-Bowie SA, Zhu Y, Foley K, Lee H, Neer RM. Two years of Denosumab and teriparatide administration in postmenopausal women with osteoporosis (the DATA extension study): a randomized controlled trial. J Clin Endocrinol Metab. 2014;99(5):1694–700.
[11] Leder BZ, Tsai JN, Uihlein AV, Wallace PM, Lee H, Neer RM, Burnett-Bowie SA. Denosumab and teriparatide transitions in postmenopausal osteoporosis (the DATA-Switch study): extension of a randomised controlled trial. Lancet (London, England). 2015;386(99):1147–55.
[12] Mehler PS, Blalock DV, Walden K, Kaur S, McBride J, Walsh K, Watts J. Medical findings in 1,026 consecutive adult inpatient-residential eating disordered patients. Int J Eat Disord. 2018;51(4):305–13.