L’approccio diagnostico e terapeutico alle malattie neuromuscolari chiede al clinico di valutare diverse condizioni di malattie che vanno oltre il quadro neuromuscolare specifico che ha portato il paziente all’osservazione del neurologo. Tra gli aspetti extraneurologici sono particolarmente frequenti le alterazioni endocrino-metaboliche, che sono in alcuni casi determinate dalle alterazioni genetiche che causano la malattia neuromuscolare come nelle distrofie miotoniche tipo 1 e tipo 2, in cui frequente e spesso precoce è la comparsa di infertilità e ipogonadismo. Inoltre gli studi più recenti dimostrano che il muscolo è caratterizzato da una funzione endocrina, mediata dal rilascio di miokine, la cui integrità è fondamentale per l’omeostasi di altri metabolismi, come quello osseo e quello glucidico. In questa presentazione si illustrano le acquisizioni più recenti relative a tali aspetti nelle più comuni patologie neuromuscolari.
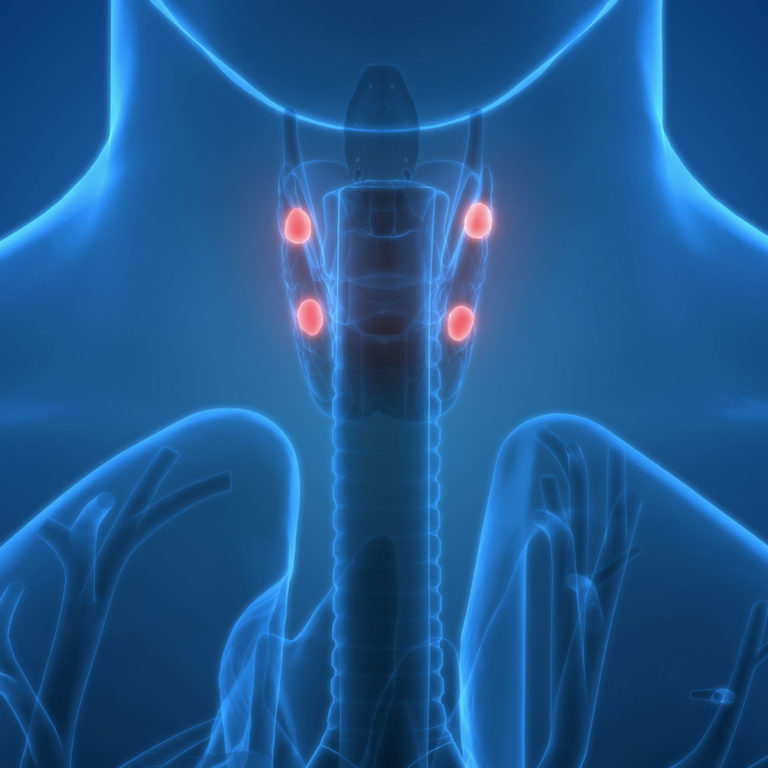
Ipoparatiroidismo: dalla diagnosi alla terapia
L’ipoparatiroidismo cronico è una condizione caratterizzata da una ridotta o assente secrezione di paratormone, con conseguente ipocalcemia e sintomi ad essa correlati. La terapia si basa sull’assunzione di calcio e forma attiva della vitamina D e, in un prossimo. Futuro, del paratormone umano ricombinante che rappresenta l’ultima terapia sostitutiva delle insufficienze ghiandolari endocrine, in Italia ancora mancante.
Presentiamo una completa disamina della patologia dall’epidemiologia, alla distinzione tra la forma primaria e quella secondaria, per arrivare alla corretta diagnosi. La presentazione di casi clinici aiuta a comprendere come il goal sia quello di mantenere il paziente asintomatico nel tempo con l’impostazione della corretta terapia.
Osso e muscolo: effetti dell’ipovitaminosi D
Approccio multidisciplinare alla gestione del paziente osteoporotico sarcopenico
Quando serve la densitometria ossea (MOC)
La densitometria ossea, conosciuta anche come MOC (Mineralometria Ossea Computerizzata), è l’esame principale per valutare la densità delle ossa. È uno strumento semplice ma fondamentale nella diagnosi precoce di osteopenia e osteoporosi, soprattutto nelle persone più a rischio.
A cosa serve la MOC
La MOC misura la quantità di minerali, in particolare calcio, presente nelle ossa. Più alta è la densità ossea, maggiore è la resistenza dello scheletro e minore il rischio di fratture. L’esame consente di individuare per tempo una perdita ossea che, se trascurata, potrebbe evolvere in osteoporosi.
Chi dovrebbe farla
La MOC è consigliata:
-
alle donne dopo la menopausa
-
agli uomini sopra i 65 anni
-
a chi ha avuto fratture da fragilità
-
a chi assume cortisonici per lunghi periodi
-
in caso di malattie croniche che compromettono il metabolismo osseo (es. celiachia, artrite reumatoide, ipoparatiroidismo)
Come si svolge l’esame
È un esame rapido, indolore e non invasivo. Il paziente si sdraia su un lettino e un braccio meccanico esegue la scansione, solitamente a livello della colonna lombare e del femore. L’esposizione ai raggi X è minima e non ci sono particolari preparazioni da seguire.
Cosa significano i risultati
Il referto riporta un valore chiamato T-score:
-
T-score > -1: densità ossea normale
-
T-score tra -1 e -2,5: osteopenia (riduzione lieve)
-
T-score < -2,5: osteoporosi
In base al risultato, il medico valuterà il livello di rischio e la necessità di ulteriori accertamenti o terapie.
Quando ripetere la MOC
In assenza di osteoporosi, la MOC può essere ripetuta ogni 2-3 anni. In presenza di osteopenia o osteoporosi già diagnosticata, può essere utile ogni 12-24 mesi, per monitorare l’efficacia della terapia e l’evoluzione della densità ossea.
Perché è importante
La MOC permette una diagnosi precoce: sapere di avere ossa fragili prima che si verifichi una frattura consente di intervenire per tempo. È uno strumento essenziale nella strategia di prevenzione e cura della fragilità ossea.
Linee guida internazionali per l’XLH pediatrica: diagnosi, monitoraggio e trattamento
Negli ultimi cinque anni si è ampliata la comprensione dell’ipofosfatemia legata all’X (XLH), una rara malattia genetica che colpisce primariamente lo scheletro e i denti nei bambini. Un gruppo internazionale di esperti, provenienti da cinque continenti, ha recentemente pubblicato nuove linee guida cliniche per la diagnosi, la gestione e il follow-up dell’XLH pediatrica. Il documento, pubblicato sul Journal of Clinical Endocrinology & Metabolism, rappresenta il primo consenso globale redatto secondo la metodologia GRADE, fornendo raccomandazioni strutturate e basate sull’evidenza.
Diagnosi: approccio clinico e genetico
La diagnosi di XLH si basa sulla presenza di ipofosfatemia cronica, assenza di altre cause note di perdita renale di fosfato e pattern ereditario X-linked. Il pannello di esperti propone un percorso diagnostico che include valutazione biochimica (fosforo, calcio, ALP, 25(OH)D, 1,25(OH)₂D, PTH), test urinari e, ove necessario, test genetico del gene PHEX e altri geni associati a rickets ipofosfatemico. Le indagini radiologiche (RX arti inferiori, ecografia renale) e l’esame odontoiatrico completano il quadro diagnostico iniziale.
Manifestazioni cliniche
Tra le caratteristiche più comuni nei bambini con XLH si riscontrano deformità degli arti inferiori, bassa statura, dolore osseo, ritardo motorio, dolicocefalia da craniostenosi, ascessi dentali e, meno frequentemente, sintomi neurologici (malformazione di Chiari 1, idrosiringomielia). È frequente anche una compromissione della qualità della vita, con impatti significativi su mobilità, autonomia e dolore cronico.
Terapia: burosumab al centro delle raccomandazioni
Il punto centrale delle nuove linee guida è la raccomandazione forte (moderata certezza) all’impiego di burosumab nei bambini ≥12 mesi di età con XLH, rispetto alla terapia convenzionale (sali di fosfato e vitamina D attiva). Nei bambini tra 6 e 12 mesi, la raccomandazione è condizionata, per via delle evidenze limitate. In caso di indisponibilità del farmaco, resta valida la terapia convenzionale, preferibilmente combinata (evitando la monoterapia con fosfato).
Il trattamento deve iniziare subito dopo la conferma della diagnosi e l’approccio con burosumab richiede un aggiustamento posologico personalizzato, basato sui livelli di fosforo sierico, evitando l’iperfosfatemia. La gestione con terapia convenzionale rimane complessa, richiedendo monitoraggi frequenti, rischio di complicanze (nefrocalcinosi, iperparatiroidismo), e un impatto clinico inferiore rispetto al trattamento mirato.
Raccomandazioni sul monitoraggio
Le raccomandazioni sul follow-up sono derivate da un ampio sondaggio tra specialisti. Si suggerisce un controllo ogni 3-6 mesi con valutazioni auxologiche, biochimiche e radiologiche, inclusa un’ecografia renale annuale per la sorveglianza della nefrocalcinosi e visite odontoiatriche semestrali. La misurazione della BMD nei bambini non è raccomandata, in quanto non informativa nel contesto dell’XLH.
Complicanze e comorbidità
Il documento sottolinea l’importanza di riconoscere e gestire le complicanze renali (nefrocalcinosi, ipertensione, iperparatiroidismo terziario), neurologiche (craniostenosi, cefalea severa) e otorinolaringoiatriche (ipoacusia e acufeni già in età pediatrica). La frequenza delle complicanze renali varia ampiamente tra le coorti, con nefrocalcinosi riportata fino all’83% in Giappone e il 47% in Canada.
Salute dentale e approccio integrato
Il rischio di necrosi pulpare spontanea e infezioni dentarie nei bambini con XLH impone un approccio preventivo strutturato, con sigillatura precoce di solchi e una valutazione odontoiatrica periodica. Il trattamento medico precoce si associa a una riduzione del rischio di complicanze orali.
Prospettive future
Il panel conclude con la necessità di ulteriori studi longitudinali per valutare l’impatto a lungo termine di burosumab su crescita staturale, qualità della vita e prevenzione delle complicanze. Rimane una sfida globale la disomogeneità nell’accesso a cure specialistiche e a terapie avanzate, come burosumab, evidenziando una questione di equità sanitaria internazionale.
Le nuove linee guida rappresentano un importante passo avanti verso una gestione standardizzata e basata sull’evidenza per i bambini affetti da XLH, promuovendo un modello di cura multidisciplinare e centrato sul paziente.
Lo studio
Dalal S Ali, Thomas O Carpenter, Erik A Imel, Leanne M Ward, Natasha M Appelman-Dijkstra, Catherine Chaussain, Suzanne M Jan de Beur, Pablo Florenzano, Hajar Abu Alrob, Rana Aldabagh, R Todd Alexander, Farah Alsarraf, Signe Sparre Beck-Nielsen, et. all, X-Linked Hypophosphatemia Management in Children: An International Working Group Clinical Practice Guideline, The Journal of Clinical Endocrinology & Metabolism, Volume 110, Issue 7, July 2025, Pages 2055–2070
La celiachia e le ossa: perché fare attenzione
La celiachia è una malattia autoimmune che colpisce l’intestino in risposta al glutine, una proteina presente nel frumento, nell’orzo e nella segale. Ma ciò che molti non sanno è che questa condizione può compromettere anche la salute delle ossa.
Cos’è la celiachia
Nei celiaci, l’assunzione di glutine provoca una reazione infiammatoria nell’intestino tenue che danneggia i villi intestinali, riducendo la capacità di assorbire nutrienti fondamentali come calcio, vitamina D e altri micronutrienti.
Perché colpisce le ossa
La carenza cronica di calcio e vitamina D, dovuta al malassorbimento, può portare a osteopenia o osteoporosi, anche in età giovane. Questo rende la celiachia una causa “secondaria” ma importante di fragilità ossea.
Segnali d’allarme
Nei casi non diagnosticati, i sintomi possono essere vaghi: dolori ossei, stanchezza, crampi muscolari. In altri casi, la celiachia si manifesta direttamente con una frattura da fragilità, portando poi a indagare le cause con esami del sangue e densitometria ossea.
La diagnosi è il primo passo
È fondamentale identificare la celiachia con esami specifici (anticorpi anti-transglutaminasi e biopsia intestinale). Una volta confermata, la dieta priva di glutine è l’unica terapia realmente efficace per permettere all’intestino di guarire e ricominciare ad assorbire correttamente.
Prevenzione e integrazione
Una dieta senza glutine ben bilanciata, ricca di calcio e vitamina D, è indispensabile. Nei primi mesi dopo la diagnosi, il medico può prescrivere integratori per compensare le carenze. Anche l’esposizione al sole e l’attività fisica regolare aiutano a proteggere lo scheletro.
Controlli regolari
Le persone con celiachia dovrebbero eseguire periodicamente la MOC per monitorare la densità ossea, soprattutto se la diagnosi è avvenuta in età adulta o dopo anni di sintomi trascurati. La prevenzione delle fratture parte dalla consapevolezza.
Nuove evidenze per la gestione dell’osteoporosi indotta da glucocorticoidi in età pediatrica
L’osteoporosi indotta da glucocorticoidi (GIO) nei bambini rappresenta una delle complicanze più insidiose delle terapie antinfiammatorie sistemiche. Per decenni sottovalutata, la fragilità scheletrica in età pediatrica ha oggi nuovi strumenti di identificazione e gestione, grazie ai risultati dello studio STOPP (STeroid-induced Osteoporosis in the Pediatric Population) e all’approccio proposto da Leanne Ward e colleghi in un’analisi pubblicata sul Journal of Clinical Endocrinology & Metabolism.
La chiave di volta: la frattura vertebrale
La frattura vertebrale – spesso asintomatica – è emersa come firma clinica della GIO pediatrica. Il dato più eclatante del progetto STOPP, che ha seguito oltre 400 bambini sottoposti a GC per patologie diverse (artriti, distrofie, malattie autoimmuni, leucemie), è che un terzo di questi sviluppa fratture vertebrali entro il primo anno di trattamento. Spesso in silenzio. L’assenza di dolore o di segni clinici e la normalità apparente della densità minerale ossea (BMD) possono trarre in inganno. Solo un imaging vertebrale laterale sistematico – con RX o DXA – può rivelare la presenza di deformità, anche gravi.
Il paradigma si rovescia: dalla BMD alla morfologia vertebrale
Tradizionalmente, la diagnosi di osteoporosi nei bambini si basava su Z-score di BMD ≤−2. Tuttavia, il lavoro dimostra che questo approccio è insufficiente. In molti casi, i bambini affetti da osteoporosi clinicamente significativa presentano Z-score normali, soprattutto nei primi anni di vita, quando il DXA è difficile da eseguire con precisione. La nuova prospettiva propone la frattura (specie vertebrale) come criterio centrale, indipendente dalla densità ossea misurata.
L’importanza del contesto clinico
L’osteoporosi da GC non si manifesta in modo uniforme. L’evoluzione dipende da fattori chiave: durata e intensità dell’esposizione ai GC, età, malattia di base e potenziale residuo di crescita. I pazienti pediatrici si dividono in tre categorie prognostiche:
-
Rischio transitorio (es. leucemia): esposizione intensa ma limitata nel tempo; alta probabilità di recupero spontaneo.
-
Rischio variabile (es. artriti autoimmuni): andamento clinico instabile, con possibilità intermedie di guarigione.
-
Rischio permanente (es. distrofia muscolare di Duchenne): esposizione cronica e progressiva, con necessità pressoché certa di trattamento farmacologico.
La crescita come fattore terapeutico
Un concetto centrale emerso dallo studio è il potenziale di “rimodellamento vertebrale mediato dalla crescita”: bambini molto piccoli, con malattia controllata e una buona riserva di crescita, possono rimodellare in modo completo vertebre fratturate senza bisogno di bisfosfonati. È il caso emblematico della prima paziente descritta nello studio, una bambina con artrite idiopatica sistemica, in grado di recuperare completamente la morfologia vertebrale con la sola sospensione dei GC e un buon controllo clinico.
Quando trattare (e come)
Se il potenziale di recupero è basso o la fragilità è avanzata, si rende necessaria la terapia farmacologica. I bisfosfonati per via endovenosa (pamidronato o zoledronato) sono oggi il gold standard. I risultati dello studio dimostrano:
-
Riduzione del dolore e miglioramento della qualità di vita;
-
Rimodellamento vertebrale in corso di terapia, con densificazione dell’endplate e ripristino dell’altezza vertebrale;
-
Incremento della densità minerale ossea in diversi distretti (LS, TBLH, femore).
Nel secondo caso esemplificativo (bambina con dermatomiosite giovanile), l’introduzione precoce di pamidronato ha permesso una normalizzazione completa della colonna vertebrale, anche dopo una recidiva della malattia.
I limiti del trattamento nei casi ad alto rischio
Nel terzo caso clinico, un bambino con distrofia muscolare di Duchenne, la terapia con zoledronato ha migliorato la BMD e risolto il dolore lombare, ma non ha impedito una progressione delle deformità vertebrali. Il fallimento parziale è attribuibile all’associazione tra miopatia, ritardo di crescita severo e trattamento steroideo cronico. L’assenza di crescita sufficiente rende inefficace la componente “rimodellante” del trattamento.
Verso nuove terapie?
Nonostante i buoni risultati dei bisfosfonati, emerge il bisogno di trattamenti più efficaci per i casi refrattari. Le future prospettive terapeutiche includono agenti anabolizzanti, in grado di stimolare direttamente la formazione ossea, attualmente in fase di studio per l’età pediatrica.
Conclusioni operative per lo specialista
-
Qualsiasi bambino in trattamento con GC per oltre 3 mesi deve essere monitorato con imaging vertebrale entro il primo anno.
-
Le fratture vertebrali, anche asintomatiche, sono criterio sufficiente per porre diagnosi di osteoporosi.
-
Nei pazienti con elevato potenziale di crescita e malattia ben controllata, si può considerare un approccio watchful waiting.
-
Nei casi ad alto rischio o con segni di progressione, è indicato iniziare tempestivamente bisfosfonati EV, monitorando attentamente il metabolismo minerale e la funzione renale.
-
Il trattamento deve proseguire finché permangono i fattori di rischio osteoporotico (es. GC, disabilità motoria, miopatie).
Questo nuovo modello di presa in carico, centrato sulla frattura vertebrale più che sulla densitometria, segna un cambiamento culturale profondo nella gestione della salute ossea pediatrica. Un cambio di paradigma che ogni specialista del metabolismo osseo è oggi chiamato a conoscere e applicare.
Lo studio
Leanne M Ward, Sarah A Bakhamis, Khaldoun Koujok, Approach to the Pediatric Patient With Glucocorticoid-Induced Osteoporosis, The Journal of Clinical Endocrinology & Metabolism, Volume 110, Issue 2, February 2025, Pages 572–591.
Artrite reumatoide e osteoporosi: un legame importante
L’artrite reumatoide è una malattia infiammatoria cronica che colpisce le articolazioni, ma può avere effetti anche sulla salute delle ossa. Le persone con artrite reumatoide hanno un rischio più elevato di sviluppare osteoporosi e fratture.
Il legame tra artrite e ossa
L’infiammazione cronica, tipica dell’artrite reumatoide, accelera il processo di perdita di massa ossea. Inoltre, i farmaci utilizzati per controllare l’artrite, come i cortisonici, possono indebolire ulteriormente le ossa.
Chi è più a rischio
Le donne in post-menopausa, chi ha familiarità con fratture e chi assume cortisonici a lungo termine sono particolarmente vulnerabili. Anche la ridotta attività fisica dovuta al dolore articolare contribuisce a rendere le ossa più fragili.
Segnali da non trascurare
Dolori alla schiena o alle anche, perdita di statura o fratture “banali” possono essere segnali di osteoporosi. È importante parlarne con il medico, soprattutto se si convive con l’artrite reumatoide.
Come proteggere le ossa
L’alimentazione ricca di calcio e vitamina D è fondamentale. Latte, yogurt, verdure a foglia verde e pesce azzurro sono ottimi alleati. Anche l’attività fisica dolce – come camminate, yoga o tai chi – aiuta a rinforzare le ossa e a migliorare la postura.
Il ruolo delle terapie
Il medico può valutare la necessità di farmaci specifici per l’osteoporosi, come i bisfosfonati o il denosumab, in aggiunta ai farmaci per l’artrite. È importante seguire un percorso personalizzato, basato sulle proprie esigenze e condizioni.
Conclusioni
L’artrite reumatoide non colpisce solo le articolazioni, ma può mettere a rischio anche la salute delle ossa. Con un’alimentazione equilibrata, l’attività fisica e le terapie adeguate, è possibile proteggere lo scheletro e vivere meglio.
La menopausa e le ossa: consigli pratici
La menopausa è una fase naturale della vita di ogni donna, ma comporta cambiamenti significativi nella salute delle ossa. Con la diminuzione degli estrogeni, le ossa diventano più fragili e aumenta il rischio di osteoporosi.
Il legame tra menopausa e ossa
Gli estrogeni hanno un ruolo fondamentale nel mantenere la densità minerale ossea. Durante la menopausa, il loro calo accelera la perdita di massa ossea, rendendo le ossa più vulnerabili a fratture e cedimenti.
Segnali da non sottovalutare
Dolori alla schiena, perdita di statura e cambiamenti nella postura possono essere segni di fragilità ossea. Anche in assenza di sintomi, è importante parlarne con il medico e valutare la densitometria ossea (MOC).
La dieta giusta per ossa forti
Un’alimentazione equilibrata, ricca di calcio e vitamina D, è essenziale. Il calcio si trova in latticini, verdure a foglia verde e legumi. La vitamina D, che facilita l’assorbimento del calcio, si assume con il sole e con alimenti come pesce azzurro e uova.
Muoversi fa bene alle ossa
L’attività fisica regolare, come camminate, ginnastica dolce o yoga, aiuta a stimolare il metabolismo osseo, migliorare l’equilibrio e la postura. Anche piccoli gesti quotidiani, come evitare di stare troppo sedute, fanno la differenza.
Parla con il tuo medico
Il medico può consigliare integratori o terapie farmacologiche, soprattutto in presenza di osteopenia o osteoporosi. Esistono farmaci specifici che aiutano a rallentare la perdita di massa ossea e a prevenire le fratture.
Conclusioni
La menopausa è un momento delicato per la salute delle ossa, ma con la giusta attenzione è possibile proteggersi. Alimentazione sana, attività fisica e controlli regolari sono le chiavi per vivere questa fase in modo sereno e attivo.
Sbloccare il potenziale dei biosimilari: implicazioni cliniche e gestionali nell’osteoporosi
L’osteoporosi è una delle principali cause di fragilità scheletrica, con oltre 8,9 milioni di fratture osteoporotiche stimate ogni anno a livello globale. La patologia, legata a un progressivo deterioramento della microarchitettura ossea, comporta costi sanitari diretti in Europa superiori ai 56 miliardi di euro e un impatto significativo sulla qualità di vita. In questo scenario, i farmaci biologici hanno dimostrato un ruolo fondamentale, ma la sostenibilità economica è diventata una sfida cruciale per i sistemi sanitari.
Biosimilari e gestione dell’osteoporosi
I biosimilari rappresentano un’opportunità per ampliare l’accesso alle terapie biologiche, riducendo i costi e favorendo l’adozione di trattamenti efficaci come il denosumab. Secondo IQVIA, l’introduzione dei biosimilari del denosumab, prevista dal 2025, potrà generare risparmi complessivi tra 309 milioni e 1,7 miliardi di euro in Europa entro il 2030. Questo potenziale economico potrebbe essere reinvestito in programmi di screening e prevenzione delle fratture, favorendo una gestione più proattiva dell’osteoporosi.
Percorsi di cura complessi: una sfida per l’adozione
L’adozione dei biosimilari nel trattamento dell’osteoporosi è strettamente legata alla complessità dei percorsi di cura. Oltre alla gestione farmacologica, il trattamento richiede un’integrazione tra diagnosi precoce, follow-up strumentale e personalizzazione delle terapie. Le figure coinvolte – medici di medicina generale, reumatologi, endocrinologi, ortopedici e ginecologi – hanno ruoli diversi, e la loro familiarità con i biosimilari risulta disomogenea. Il sondaggio IQVIA, condotto su 266 medici in 8 Paesi europei, evidenzia come solo il 5% dei medici di base si dichiari altamente consapevole dei biosimilari disponibili, a fronte di una maggiore esperienza tra reumatologi e ortopedici.
Barriere percepite e ruolo dei dati real-world
Il 33% dei clinici intervistati lamenta una mancanza di esperienza diretta con i biosimilari, mentre la carenza di linee guida aggiornate e la scarsità di dati real-world rappresentano ulteriori ostacoli alla loro adozione. In particolare, la mancanza di studi post-marketing mirati ai pazienti osteoporotici genera incertezza, soprattutto nelle figure mediche che hanno minore esperienza con i farmaci biologici.
Strategie proposte: reti di collaborazione e gainsharing
Il report IQVIA propone una serie di interventi per favorire un uptake sostenibile dei biosimilari:
- Aggiornamento delle linee guida cliniche post-approvazione EMA, con raccomandazioni chiare sull’intercambiabilità e l’uso dei biosimilari nel trattamento dell’osteoporosi.
- Creazione di reti europee di scambio di buone pratiche, con webinar e formazione continua dedicati agli specialisti.
- Sviluppo di programmi di gainsharing, dove i risparmi generati dall’adozione dei biosimilari vengono reinvestiti in attività di prevenzione, diagnostica e gestione delle fratture.
- Implementazione di studi real-world per rassicurare i clinici sulla comparabilità in termini di efficacia e sicurezza.
Implicazioni cliniche: un’opportunità per la gestione dell’osteoporosi
L’adozione dei biosimilari offre la possibilità di ampliare l’uso dei farmaci biologici anche in pazienti a rischio elevato ma finora esclusi per motivi economici. Inoltre, la maggiore disponibilità di trattamenti biologici può favorire strategie di trattamento precoce e personalizzato, migliorando gli esiti clinici e riducendo l’incidenza di fratture da fragilità.
Il report IQVIA fornisce un quadro dettagliato delle sfide e delle opportunità connesse all’introduzione dei biosimilari nel trattamento dell’osteoporosi. Per gli specialisti del metabolismo osseo, l’adozione di questi farmaci rappresenta un’occasione per ottimizzare i percorsi di cura, contribuendo al contempo alla sostenibilità economica del sistema. L’integrazione di dati real-world, la formazione clinica mirata e la collaborazione multi-stakeholder saranno fondamentali per tradurre questo potenziale in benefici concreti per i pazienti.
Vitamina D e omega-3 non migliorano le performance fisiche negli anziani sani
Il declino della funzione muscolare in età avanzata è un predittore noto di cadute, fratture, disabilità e mortalità precoce. Di qui l’interesse per strategie preventive, tra cui la supplementazione con vitamina D e omega-3, che secondo numerosi studi osservazionali mostrano associazioni positive con la salute muscolo-scheletrica. Tuttavia, l’evidenza da trial randomizzati controllati (RCT) rimane controversa.
Lo studio ancillare del VITamin D and OmegA-3 TriaL (VITAL) — recentemente pubblicato sul Journal of Clinical Endocrinology & Metabolism — ha cercato di colmare questo vuoto conoscitivo. Il trial, condotto su una coorte di 1054 partecipanti residenti nell’area di Boston e arruolati nello studio madre VITAL, ha valutato l’effetto di due anni di supplementazione quotidiana con vitamina D3 (2000 UI) e/o acidi grassi omega-3 (1 g) su parametri oggettivi di performance fisica.
Metodo e popolazione
I partecipanti erano uomini ≥50 anni e donne ≥55 anni, senza storia di patologie oncologiche o cardiovascolari. I parametri analizzati includevano forza di prensione, velocità del cammino (normale e veloce), equilibrio statico, test di risalita dalla sedia e Timed-Up and Go (TUG). Tutti i test sono stati eseguiti al baseline e a due anni.
Il disegno era a 2×2 fattoriale, con randomizzazione doppio cieco. Le analisi statistiche hanno considerato le variazioni nei punteggi in un’ottica intention-to-treat, con aggiustamenti per età e sesso.
Risultati principali
Dopo due anni, tutti i gruppi (vitamina D, omega-3, combinazione e placebo) hanno mostrato un lieve peggioramento della velocità del cammino e dei tempi TUG, in linea con un fisiologico declino legato all’età. Tuttavia, non è stata osservata alcuna differenza significativa tra i gruppi trattati e quelli placebo in nessuno degli endpoint primari: forza di prensione, velocità del cammino, equilibrio statico, test TUG e punteggio SPPB.
Unica eccezione marginale: nei partecipanti con livelli basali di vitamina D più alti, la supplementazione ha peggiorato lievemente i tempi TUG (P per interazione = 0,04). Un dato che, secondo gli autori, potrebbe riflettere un falso positivo dovuto alla molteplicità dei confronti.
Interpretazione e limiti
I risultati vanno interpretati nel contesto di una popolazione relativamente sana, con pochi soggetti fragili o carenti. Il livello medio di 25(OH)D al baseline era di 28,1 ng/mL, sufficiente nella maggior parte dei casi. Inoltre, circa il 45% dei partecipanti assumeva già vitamina D in forma personale (≤800 UI/die), riducendo il contrasto tra gruppi.
Lo studio si distingue per l’elevato numero di partecipanti, l’aderenza al trattamento e la qualità delle misure. Tuttavia, non tutti i partecipanti hanno completato l’intero set di test funzionali, e i test TUG e SPPB sono stati introdotti solo in una fase successiva.
Conclusioni cliniche
Nel complesso, i risultati non supportano l’uso di vitamina D o omega-3 per il miglioramento delle performance fisiche in adulti sani di mezza età o anziani non selezionati per fragilità o ipovitaminosi D. Il messaggio è chiaro: in assenza di carenze diagnosticate o condizioni cliniche specifiche, l’integrazione di vitamina D o omega-3 non offre vantaggi misurabili in termini di funzione muscolare.
Per la salute ossea e muscolare dell’anziano, l’identificazione precoce della sarcopenia, l’ottimizzazione del profilo nutrizionale e l’attività fisica personalizzata rimangono i pilastri di una strategia efficace.
Lo studio
Sharon H Chou, Nancy R Cook, Gregory Kotler, Eunjung Kim, Trisha Copeland, I Min Lee, Peggy M Cawthon, Julie E Buring, JoAnn E Manson, Meryl S LeBoff, Effects of Supplemental Vitamin D3, Omega-3 Fatty Acids on Physical Performance Measures in the VITamin D and OmegA-3 TriaL, The Journal of Clinical Endocrinology & Metabolism, Volume 110, Issue 1, January 2025, Pages e44–e5.
Le fratture vertebrali: come riconoscerle e curarle
Le fratture vertebrali rappresentano una delle principali complicanze dell’osteoporosi e colpiscono spesso le donne dopo la menopausa, ma possono verificarsi anche in altre situazioni. Riconoscerle e curarle in tempo è fondamentale per evitare conseguenze sulla postura e sulla qualità di vita.
Cos’è la frattura vertebrale
Si parla di frattura vertebrale quando una delle vertebre della colonna si schiaccia o si deforma, spesso a seguito di un trauma lieve o di un carico eccessivo. Può interessare una sola vertebra o più di una, con un impatto significativo sulla statura e sulla curvatura del dorso.
Come riconoscerla
I sintomi più comuni sono dolore alla schiena improvviso e persistente, difficoltà a mantenere la postura eretta e riduzione dell’altezza. A volte il dolore può essere scambiato per un semplice mal di schiena o per affaticamento muscolare, ma se persiste è importante parlarne con il medico.
Diagnosi e esami
La diagnosi si basa sulla radiografia della colonna, che permette di visualizzare eventuali cedimenti vertebrali. In alcuni casi può essere utile una risonanza magnetica per valutare meglio la situazione. La densitometria ossea (MOC) aiuta a capire se la frattura è legata all’osteoporosi.
Come si cura
La terapia varia in base alla gravità della frattura e alla condizione generale del paziente. In molti casi si utilizzano busti o corsetti ortopedici per sostenere la colonna e ridurre il dolore. La fisioterapia è fondamentale per rinforzare la muscolatura e migliorare la postura.
Il ruolo della terapia farmacologica
Quando la frattura è legata all’osteoporosi, è importante trattare anche la causa sottostante. Farmaci come i bisfosfonati, il denosumab o le terapie anabolizzanti possono aiutare a rinforzare l’osso e prevenire nuove fratture.
Conclusioni
Le fratture vertebrali non devono essere sottovalutate. Riconoscere i sintomi, fare gli esami giusti e seguire una terapia adeguata significa proteggere la schiena e la propria autonomia. Parla con il tuo medico per un percorso di cura personalizzato e sicuro.
Ipoparatiroidismo e salute delle ossa
L’ipoparatiroidismo è una malattia rara che colpisce le ghiandole paratiroidi, responsabili della produzione dell’ormone paratormone (PTH). Questo ormone regola i livelli di calcio e fosforo nel sangue, fondamentali per la salute delle ossa.
Cos’è l’ipoparatiroidismo
Quando le paratiroidi non funzionano correttamente o sono state rimosse chirurgicamente (ad esempio dopo un intervento alla tiroide), si verifica una carenza di PTH. Senza il PTH, i livelli di calcio nel sangue si abbassano (ipocalcemia) e aumenta il fosforo (iperfosfatemia). Questo squilibrio può avere effetti importanti su muscoli, nervi e ossa.
Sintomi e segnali
I sintomi dell’ipoparatiroidismo sono legati principalmente all’ipocalcemia e possono includere formicolii, crampi muscolari, spasmi (tetania), ansia e, nei casi più gravi, convulsioni. Sul lungo termine, anche la salute delle ossa può essere compromessa, con un aumento del rischio di fragilità e fratture.
Come si diagnostica
La diagnosi si basa su esami del sangue che rilevano bassi livelli di calcio e PTH e alti livelli di fosforo. Nei casi cronici, il medico può prescrivere anche la densitometria ossea (MOC) per valutare la salute dello scheletro e monitorare eventuali segni di osteoporosi.
Le cure disponibili
Il trattamento si basa su integratori di calcio e vitamina D attiva (calcitriolo) per mantenere i livelli di calcio nel sangue nella norma. In casi particolari, si può ricorrere alla terapia sostitutiva con PTH ricombinante, un farmaco che “mima” l’azione dell’ormone mancante e migliora la salute delle ossa e dei tessuti.
L’importanza del monitoraggio
Chi soffre di ipoparatiroidismo deve seguire controlli regolari con il medico per tenere sotto controllo i livelli di calcio e fosforo e per valutare la salute delle ossa. Una dieta ricca di calcio e un’adeguata esposizione al sole possono essere utili, ma vanno sempre integrate con la terapia personalizzata prescritta dal medico.
Conclusioni
L’ipoparatiroidismo è una condizione rara, ma gestibile grazie a cure mirate e controlli periodici. Conoscere la malattia e collaborare attivamente con i professionisti della salute aiuta a mantenere un buon equilibrio e a prevenire complicanze per lo scheletro e la qualità di vita.